武大雷教授研究成果在Nature Communications上发表
山东大学生命科学学院、微生物技术国家重点实验室武大雷课题组,近日与美国桑福德伯纳姆(SBP)医学研究所Fraydoon Rastinejad课题组合作,在Nature Communications杂志(2016年影响因子:12)上发表论文“The quaternary architecture of RARβ–RXRα heterodimer facilitates domain–domain signal transmission” (2017 Oct 11; 8: 868)。SBP研究所的Vikas Chandra博士与武大雷教授为论文共同第一作者,Rastinejad教授为通讯作者。该课题得到了美国NIH和山东大学“齐鲁青年学者”学科建设经费(11200086963072)的资助。
核受体(nuclear receptor, NR)是一类配体依赖型的转录因子超家族蛋白,与机体生长发育、细胞分化以及人体内许多生理、代谢过程中的基因表达调控密切相关。核受体本身或受其调控的基因表达的紊乱也是导致癌症、糖尿病及肥胖等疾病的重要原因。视黄酸受体RAR (retinoic acid receptor)与类视黄醇X受体RXR (retinoid X receptor)都是核受体家族的成员,二者各有α/β/γ三种亚型,可分别形成RAR-RXR异二聚体,并与视黄酸受体反应元件结合而启动下游相关基因的表达,直接影响胚胎发育和细胞分化等。结合和调节RAR与RXR的小分子配体已被用于癌症(如早幼粒细胞白血病、皮肤T细胞淋巴瘤、鳞状皮肤癌等)及炎症性疾病(如严重痤疮、银屑病等)的治疗。
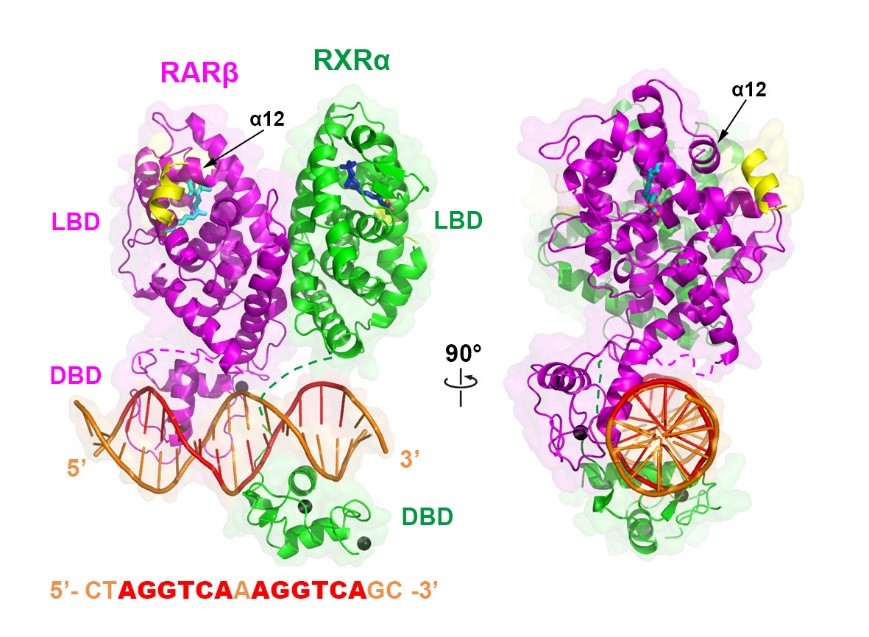
本研究报道了RARβ和RXRα全长蛋白异二聚体结合DNA、配体及共激活因子多肽的复合物晶体结构,辅以氢氘交换质谱和基于定点突变的功能研究等手段,发现RARβ的DNA结合区域(DNA binding domain, DBD)与配体结合区域(ligand binding domain, LBD)有着直接的相互作用,使变构调节(allosteric regulation)的信号得以在二者之间传递。此外,通过与其它已知的二聚化全长核受体晶体结构(包括PPARγ-RXRα、LXRβ-RXRα和HNF-4α)的比较,发现它们的总体四级结构存在较大差异,并非如之前Moras等人预测的遵循相同的模式(Nat Struct Mol Biol2011 May; 18: 564-70)。但同时这些RXR异二聚体的结构也存在一定的相似之处,比如RXR的DBD和LBD间距离较远,除肽链连接外无直接相互作用,使RXR保持相对灵活的构象以适应不同的二聚伙伴蛋白;而其二聚伙伴的DBD 与LBD间存在直接相互作用,且有意思的是它们都利用LBD表面一个相似的区域(surface patch)与各自DBD的不同部位发生作用。这个全长RARβ-RXRα异二聚体结构不仅直观地展示了核受体蛋白不同结构域之间变构信号传递的方式,而且为进一步针对视黄酸通路开发相关药物提供了重要信息。
武大雷教授2016年9月回国加入山东大学微生物技术国家重点实验室,主要研究领域为靶点蛋白的结构和功能及相关药物发现,包括bHLH-PAS转录因子和核受体家族等。相关成果以第一作者分别发表在Nature、Elife、Curr Opin Struct Biol、Mol Cell Biol、Arterioscler Thromb Vasc Biol、Toxicology等国际学术期刊上。
论文全文链接:https://www.nature.com/articles/s41467-017-00981-y
|

